PQQ 吡咯喹啉醌 对衰老大鼠学习记忆的影响及机制研究
酶标仪(美国美谷)、二氧化碳培养箱(美国赛默飞)、Morris水迷宫(中国医学科学院药物研究所)、电子天平、低速冷冻多管离心机。
吡咯喹啉醌(PQQ),纯度99%,购自浙江省海正药业股份有限公司,用蒸馏水配制成10、20、40 mg/kg 3种浓度PQQ储备液。F-12K培养基(美国Sigma Aldrich),胎牛血清、马血清均购自天津润泰生物科技有限公司,大鼠嗜铬细胞瘤细胞PC12、噻唑兰(MTT)试剂盒、超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、脂褐素测试盒、总抗氧化能力(T-AOC)测试盒均购自南京建成生物工程研究所。
解冻PC12细胞(大鼠肾上腺髓质嗜铬瘤分化细胞株),用含体积分数10%胎牛血清、1%马血清的F-12培养基作为传代培养基,每48 h传代一次。多次传代复壮后,取生长对数期的PC12细胞,5 000 r/min离心5 min,弃上清。用血球计数板,将沉淀用纯F-12培养液稀释成8×104个/ml的PC12细胞工作液待用。
取96孔板,第1列8孔为试剂空白组;第2列8孔为对照组,PC12细胞正常生长;第3列8孔为氧化模型组,使用过氧化氢(H2O2)氧化建模;第4列~第12列各8孔为PQQ修复作用测试组,使用不同浓度PQQ修复被H2O2氧化的细胞。试验收集PC12对数期细胞,第1列加入F-12K培养基100 μl,第2列~第12列加入PC12细胞工作液100 μl。5% CO2、37 ℃孵育,使细胞单层贴壁铺满96孔板。18 h后,分别在第3列~第12列加入3 μl 10 mmol/L的H2O2,形成终浓度为0.3 mmol/L的H2O2溶液,对PC12细胞进行氧化建模,随后在5% CO2、37 ℃条件下孵育。培养24 h后弃去培养液,各孔加入F-12K试验用培养液100 μl。第4列~第12列分别另加入PQQ溶液,分别使PQQ在培养液中的浓度达到10、20、50、100、200、400、600、800、1 000 nmol/L,5% CO2、37 ℃孵育60 h。待PQQ充分发挥其抗氧化以及对细胞修复作用之后,每孔加入20 μl MTT,在5% CO2、37 ℃条件下孵育4 h后弃去培养基,每孔加入150 μl 二甲基亚砜,振荡10 min,490 nm测定吸光度。试验重复3次。
所有SD大鼠给予普通饲料,进行适应性喂养7 d。12只6周龄雄性SD大鼠作为青年对照组。48只18月龄SD大鼠眼眶静脉丛采血,检测血清中SOD、MDA水平。按照体质量和血清中SOD、MDA水平分为4组,每组12只,分别为衰老模型组、PQQ高剂量组(40 mg/kg)、PQQ中剂量组(20 mg/kg)、PQQ低剂量组(10 mg/kg),使组间体质量、SOD、MDA水平无差异。
青年对照组、衰老模型组每日上午灌胃双蒸水1次,灌胃量按照大鼠体质量进行计算,为0.1 ml/10 g,连续灌胃6周;各剂量组每日灌胃相应受试药物,PQQ高剂量组的浓度为40 mg/kg;PQQ中剂量组的浓度为20 mg/kg;PQQ低剂量组的浓度为10 mg/kg,灌胃量均为0.1 ml/10 g,每日上午灌胃1次,连续6周。
当所有大鼠灌胃至第4周时,使用Morris水迷宫测试大鼠学习记忆能力。灌胃到第6周结束时,进行生化指标测试。末次给药后禁食12 h,腹腔注射1%戊巴比妥溶液进行麻醉,每100 g体质量0.5 ml。随后腹主动脉采血,血样按试剂盒操作说明检测血清中SOD、GSH-Px活力和MDA含量。同时将大鼠放置于冰面上,迅速取右侧大脑组织,制成质量比为10%的组织匀浆,按试剂盒操作说明测定脑组织SOD、T-AOC、GSH-Px活力和脂褐素、MDA的含量。
Morris圆形水迷宫主要由圆形不锈钢水池(直径120 cm,高50 cm)和隐藏平台(直径9 cm,高27 cm)组成,水池上空通过一个数字摄像机与计算机相连接,对动物活动进行全程跟踪。试验时将水池内的水用黑色墨汁染色,以隐藏平台,水面高出平台表面1 cm,水温控制在(22±0.5)℃。整个试验过程分为隐藏平台获得试验和空间探索试验两部分。
隐藏平台获得试验:旨在评价大鼠的学习和记忆能力。试验开始前,让大鼠自由游泳2 min以适应周围环境。正式试验开始时,随机从东、西、南、北4个入水点选择一个,将大鼠面向池壁放入水中,记录其寻找并爬上平台所需时间即逃避潜伏期。如果大鼠在90 s内未找到平台,将其引至平台停留30 s,潜伏期记为90 s;若大鼠找到平台,需停留10 s。试验历时5 d,每天每只大鼠训练2次。计算每天各组2次寻找平台潜伏期和总路程的平均值记为当天的寻找平台潜伏期和总路程[4]。
空间探索试验:旨在评价大鼠空间位置记忆保持的能力。训练5 d后,大鼠休息24 h,于第7天去除平台,任选一个入水点将大鼠放入水中,记录60 s内,大鼠在目标象限(原平台所在象限)穿越目标次数,记为穿越次数。
研究数据用SPSS 20.0软件统计并分析,计量资料数据结果均采用均值±标准差(±s)表示,组间差异做两样本均数比较的t检验,以P<0.05为差异有统计学意义。
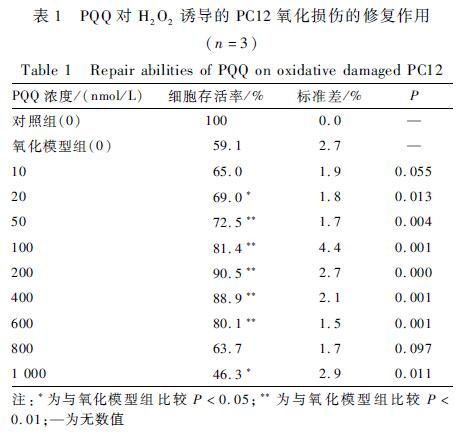 |
表1PQQ对H2O2诱导的PC12氧化损伤的修复作用(n=3) Table 1Repair abilities of PQQ on oxidative damaged PC12 注:*为与氧化模型组比较P<0.05;**为与氧化模型组比较P<0.01;—为无数值 |
表2可知,在隐藏平台获得试验中,与衰老模型组比较,PQQ中剂量组和高剂量组(20、40 mg/kg)5 d潜伏期明显缩短、5 d总路程明显减少,均差异有统计学意义(P<0.05)。在空间探索试验中,与衰老模型组比较,PQQ各剂量组的7 d穿越平台次数均有增加,7 d第一次平台穿越时间均有缩短,均差异有统计学意义(P<0.05)。
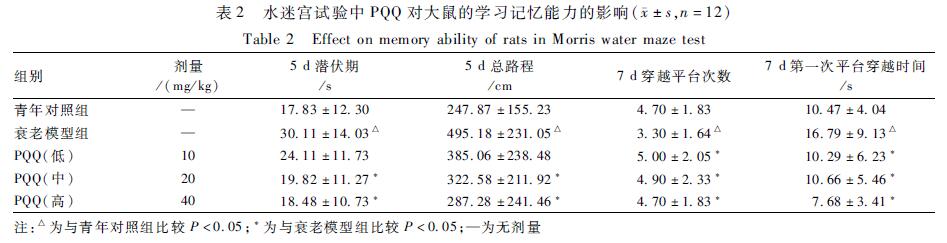 |
表2水迷宫试验中PQQ对大鼠的学习记忆能力的影响(±s,n=12) Table 2Effect on memory ability of rats in Morris water maze test 注:△为与青年对照组比较P<0.05;*为与衰老模型组比较P<0.05;—为无剂量 |
| 图1各组大鼠在水迷宫试验最后一天(第5天)的典型游泳轨迹 Figure 1Representative swimming paths of the different rat groups on last day (day 5) in the Morris water maze test |
表3可见,与衰老模型组比较,PQQ各剂量组(10、20、40 mg/kg)血清中MDA含量均降低,PQQ中和高剂量组(20、40 mg/kg)血清中SOD、GSH-Px活力升高,均差异有统计学意义(P<0.05)。
与衰老模型组比较,PQQ各剂量组的脑组织中MDA含量降低,GSH-Px活力升高,T-AOC能力增强,脂褐素含量降低,均差异有统计学意义(P<0.05)。PQQ高剂量组(40 mg/kg)大鼠脑组织中SOD活力高于衰老模型组,差异有统计学意义(P<0.05)。结果见表4。
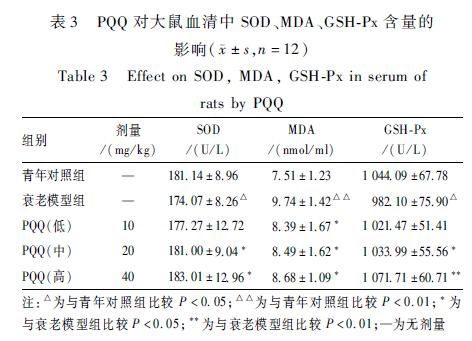 |
表3PQQ对大鼠血清中SOD、MDA、GSH-Px含量的 影响(±s,n=12) Table 3Effect on SOD, MDA, GSH-Px in serum of rats by PQQ 注:△为与青年对照组比较P<0.05;△△为与青年对照组比较P<0.01;*为与衰老模型组比较P<0.05;**为与衰老模型组比较P<0.01;—为无剂量 |
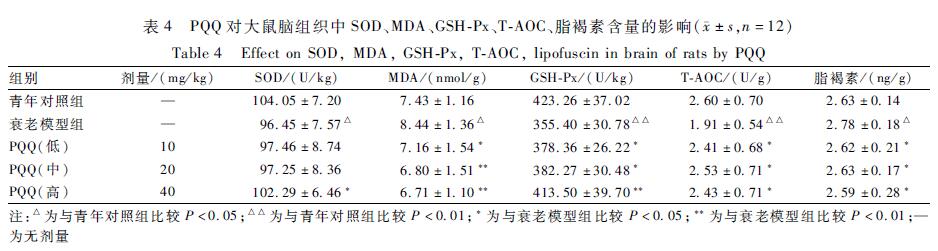 |
表4PQQ对大鼠脑组织中SOD、MDA、GSH-Px、T-AOC、脂褐素含量的影响(±s,n=12) Table 4Effect on SOD, MDA, GSH-Px, T-AOC, lipofuscin in brain of rats by PQQ 注:△为与青年对照组比较P<0.05;△△为与青年对照组比较P<0.01;*为与衰老模型组比较P<0.05;**为与衰老模型组比较P<0.01;—为无剂量 |
Morris水迷宫是英国心理学家Morris于20世纪80年代初设计并应用于脑学习记忆机制研究的一种试验手段,其在阿尔茨海默病研究中的应用非常普遍。试验中,衰老组大鼠的学习记忆能力弱于青年组大鼠,PQQ灌胃4周后,衰老大鼠在隐藏平台获得试验和空间探索试验中搜索平台的时间与路程明显缩短,随着PQQ剂量浓度的增加,特别是高剂量组(40 mg/kg)大鼠对平台位置的记忆比衰老模型组大鼠更加深刻,学习记忆能力有明显的提高,证明PQQ具有提高衰老大鼠学习记忆能力、改善记忆障碍的功能。
PQQ能够保护细胞免受氧化应激损伤,进而减轻各种器官受到氧自由基的侵害[8]。大脑中含有大量自由基,最容易受到氧化损伤,这也是导致老年学习记忆能力减退的主要原因。因为脑组织中的不饱和脂质含量高,易被自由基氧化[7]。MDA的浓度可反映机体内脂质过氧化的程度。SOD是消除O2-毒性效应最重要的抗氧化酶,GSH-Px是清除脂类氢过氧化物的过氧化物分解酶,它们都是机体抗过氧化能力指标。T-AOC是指酶与非酶的总体抗氧化自由基的能力。脂褐素是脑组织衰老细胞中细胞氧化后的产物,沉积会引起智力和记忆力的减退。
目前为止,PQQ在学习记忆能力方面,还未有相关的文献报道。本试验显示,摄入PQQ能明显提高衰老大鼠血清及脑组织中SOD、GSH-Px活力,使老年大鼠大脑与机体的抗氧化能力大大增强,延缓了大脑因神经细胞氧化导致的学习记忆能力减退。衰老大鼠血清中MDA及脑组织中MDA和脂褐素含量明显降低,证明大鼠体内的不饱和脂质的氧化过程被有效阻断,标志着PQQ的抗氧化作用得到了充分发挥。PQQ剂量组与衰老模型组的脑组织中T-AOC的含量差异,反映了PQQ能增加老年大鼠大脑总体抑制自由基的氧化反应能力,对因衰老导致的脑组织氧化损伤具有积极的保护作用。试验证明,PQQ能够有效的从抗氧化途径发挥作用,增加大鼠的学习记忆能力。同时也有相关毒理学试验[9]报道,大鼠口服400 mg/kg的PQQ,经过41 d与91 d的喂养试验,证明该剂量是一个安全剂量,未表现出相关的毒性危害。
[2]HE K, NUKADA H, URAKAMI T, et al. Antioxidant and pro-oxidant properties of pyrroloquinoline quinone (PQQ) implications for its function in biological systems[J]. Biochemical Pharmacology, 2003, 65(1): 67-74.
[3]GONENC S, UYSAL N, ACIKGOZ O, et al. Effects of melatonin on oxidative stress and spatial memory impairment induced by acute ethanol treatment in rats[J]. Physiol Res, 2005, 54(3):341-348.
[4]ELDER G A, GAMA SOSA M A, DE GASPERI R, et al. Presenilin transgenic mice as models of Alzheimers disease[J]. Brain Structure and Function, 2010, 214(2/3):127-143.
[5]KOIVISTO K, REINIKAINEN K J, HANNINEN T, et al. Prevalence of age-associated memory impairment in a randomly selected population from eastern Finland[J]. Neurology, 1995, 45(4): 741-747.
[6]LAEDERACH A, SHCHERBAKOVA I, JONIKAS M A, et al. Distinct contribution of electrostatics, initial conformational ensemble, and macromolecular stability in RNA folding[J]. Proceedings of the National Academy of Sciences, 2007, 104(17):7045-7050.
[7]DRINGEN R. Metabolism and functions of glutathione in brain[J]. Progress in Neurobiology, 2000, 62(6):649-671.
[8]KUMAR N, KAR A. Pyrroloquinoline quinone (PQQ) has potential to ameliorate streptozotocin-induced diabetes mellitus and oxidative stress in mice: a histopathological and biochemical study[J].Chemico-Biological Interactions, 2015, 240(10):278-290.
[9]LIANG C L, ZHANG X, WANG W, et al. A subchronic oral toxicity study on pyrroloquinoline quinone (PQQ) disodium salt in rats[J].Food and Chemical Toxicology, 2015,75(1):146-150.
![]()
![专业人士都爱的cele,大家买了没有[嘿哈]](http://health-anything.com/wp-content/uploads/2025/10/VTN-cel-768x1367.jpg)