这是法国巴黎大学Christelle Nguyen等刚刚在权威杂志”营养”上发表的一篇综述,特翻译过来,以求对大家有所帮助。
陈铁华 医学博士 译自 Nutrients. 2017 Jan; 9(1): 45
摘要:
反式白藜芦醇(t-Res)是一种在多种植物中发现的羟基芪类天然化合物。由于其对脂质和花生四烯酸代谢及其抗氧化活性的影响,白藜芦醇被认为是红葡萄酒的主要心脏保护成分,导致了”法国悖论”的健康概念。在过去十年中,白藜芦醇对人类健康影响的研究在诸如癌症,神经变性和心血管疾病以及代谢疾病的不同领域中已经取得显著进展。在风湿性疾病领域,体外研究表明白藜芦醇在各种关节细胞类型(包括软骨细胞和滑膜细胞)以及在T和B免疫调节特异性淋巴细胞中的抗炎,抗分解代谢,抗凋亡和抗氧化性质。在骨关节炎和类风湿性关节炎的临床前期模型中,白藜芦醇显示出关节保护作用,主要通过减少促炎和促降解可溶性因子的产生以及调节细胞和体液免疫应答来介导。在这里,作者全面综述了支持白藜芦醇在治疗风湿性疾病相关的症状具有潜在治疗价值的证据。
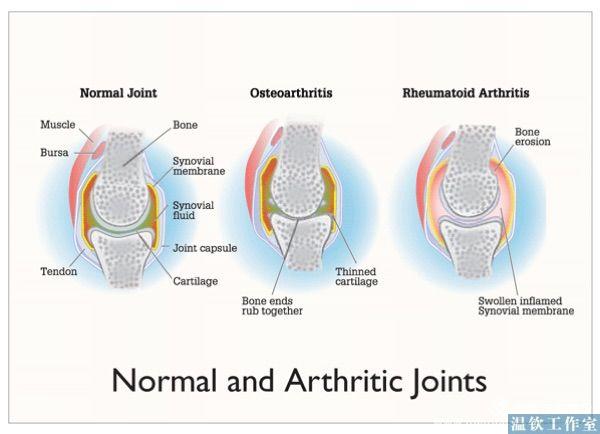
1.前言
地中海社会在希腊医学的影响下发展了”地中海饮食”。这种饮食包括适量摄入动物肉类和脂肪,结合大量的蔬菜,水果和橄榄油。天然抗氧化剂,纤维,B族维生素和不饱和脂肪酸也存在于作为每天饮用的基本的酒精饮料红葡萄酒中 [1]。这种饮食对预防冠心病的有益效果一直存在争论,包括最近对”法国悖论”的争论。源于这一概念的研究表明,与其他西方人群相比,尽管存在高动物脂肪摄入,低运动水平和严重吸烟等高风险因素,喜欢饮酒的法国人群的冠心病发生率较低[2]。始于流行病学研究的这种争论,因为一些阴性实验结果而加剧[3],最终形成了红酒可能含有心脏保护化合物,特别是抗氧化多酚物质的理论。
事实上,红葡萄酒含有几种多酚,包括酚酸,羟基均二苯乙烯和类黄酮。反式白藜芦醇(3,5,4′-三羟基芪,t-Res)是在多种植物如葡萄,花生,松树或中国旋花中以顺式和反式构型存在的羟基均二苯[3]。由于其对脂质和花生四烯酸代谢及其抗氧化活性的影响,白藜芦醇被认为是红葡萄酒的主要心脏保护成分。在葡萄中,白藜芦醇作为抗真菌植物抗毒素产生,以响应黑曲霉的感染。白藜芦醇在红葡萄酒中的浓度范围为0.1〜14.5 mg / L [4] 。几种亚洲药典描述了中草药虎仗(Polygonum cuspidatum)粉作为抗炎药,用于各种条件如疼痛,发热,皮炎,动脉粥样硬化,高脂血症和癌症[5]。实验和临床数据表明,白藜芦醇抗炎和镇痛作用可能作为关节疾病的补充治疗具有临床意义[4,6]。白藜芦醇作用机制提示白藜芦醇可以调节失衡的内分泌,凋亡和氧化应激。在这里,作者全面综述了支持白藜芦醇在治疗风湿性疾病相关的症状具有潜在治疗价值的证据。选择文献的过程是非系统的,并基于作者的专业知识,自我知识和反思实践。
2. 文献综述
2.1 白藜芦醇的靶分子
在各种模型中白藜芦醇的药理学性质已经在文献中广泛描述[6,7,8,9,10,11,12]。有关白藜芦醇的有益性质的假说包括通过拮抗芳烃和二恶英受体(AhR),激酶抑制,抗炎,止痛和抗肿瘤活性从而解除体内毒素。 这些作用是所报道的白藜芦醇在肿瘤发生,心血管和神经变性疾病中的保护作用以及对葡萄糖内稳态的代谢作用的基础(图1)。
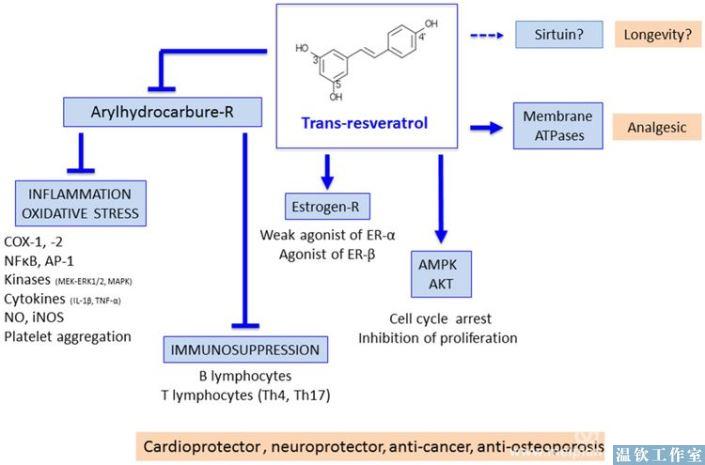
初步报告显示,白藜芦醇在急性和慢性炎症阶段的抗炎活性与其调节环加氧酶(COX)-1和-2 [5,13]的能力相关。在分子水平鉴定的第一个目标是AhR [14]。芳烃和二恶英存在于烟雾,尾气和工业废气中。 AhR激活促进内分泌破坏,氧化应激,炎症,凋亡和免疫抑制,并且与糖尿病,骨质疏松症和癌症的风险增加相关。白藜芦醇是一种强AhR竞争性拮抗剂(IC50 6μM),能够抑制与AhR活化相关的作用[14]。作为二苯乙烯,白藜芦醇是膜ATP酶的调节剂[15],与其镇痛作用相关。作为多酚,白藜芦醇是雌激素受体(ER)-α的弱激动剂和ER-β的激动剂[16],与其骨保护作用相关。我们的设计的基于白藜芦醇的结构的AhR拮抗剂,没有与ER的任何相互作用[17]。作为多酚,白藜芦醇也是一种酪氨酸激酶抑制剂(IC50 10-25μM),是各种组织中MEK-ERK1 / 2,MAPK,AP-1和NF-κB通路的调节剂[18,19,20,21]。白藜芦醇可抑制小鼠中肿瘤前病变的化学诱导。白藜芦醇被认为是通过抑制COX和氢过氧化物酶,通过诱导2期药物代谢酶,通过其抗氧化活性和通过诱导癌细胞分化而起作用[22]。白藜芦醇也可以调节细胞周期和凋亡[23,24]。最近,AhR作为先天免疫和适应性反应的调节剂的生理作用已被证明[25]。 AhR的阻断导致免疫器官和功能的发育受损[26,27]。通过特定配体激活AhR可在二恶英和白藜芦醇影响下在免疫调控T,Th17和B淋巴细胞中诱导广泛的生物效应[28,29]。这样可以模拟由未知的生理配体引起的生理作用。
最后,必须提及sirtuin(Sirt)-1争议。现有研究提示白藜芦醇激活Sirt-1改善糖尿病性心肌病动物模型中的心脏功能 [30]。然而,这些发现是否可以应用到其他心血管疾病仍然有争议。到目前为止,白藜芦醇延长生命的能力已经在酵母,无脊椎动物和小鼠中证实。小鼠即使喂食高脂肪饮食,在白藜芦醇或sirtuin活化剂治疗下活得更长。小鼠在癌症和衰老方面与人类有一些差异。他们拥有活跃的端粒酶,他们没有”骨骼”青春期,因为他们的软骨直到死亡都在生长。小鼠由于缺乏其内源性负调节剂7-酮 – 胆固醇而具有极其敏感的AhR [31]。此外,与通常的大多数哺乳动物相比,C57B16小鼠品系具有异常AhR。这个”超级”AhR是否通过增强氧化代谢产生sirtuins激活剂呢?到目前为止,白藜芦醇和sirtuins之间是否有直接联系尚不清楚。如图所示5’腺苷单磷酸激活蛋白激酶(AMPK)和过氧化物酶体增殖物激活受体γ共激活因子(PGC)-1的增加可能被解释为对药物的促进作用的反应[33]。当白藜芦醇以适当的盖伦制剂(复合制剂)形式使用时,Park和同事在体内使用的剂量为150mg(腹膜内)和3000倍(口服)40mg /天的完全活性剂量[34]。在Park和同事的论文中使用的剂量在50μM的左右,能够激活ER [16](个人数据)。雌二醇效应包括AMPK和PGC-1诱导[35,36]。此外,尽管有人声称老化不是一种疾病,关于白藜芦醇,sirtuin,卡路里限制,衰老疾病和衰老本身的复杂关系仍然值得考虑 [37]。
2.2 生物利用度的问题
白藜芦醇生物利用度在动物和人类研究中都很差,由于摄取率低和广泛的代谢,特别是经过体内硫酸化和葡糖醛酸化。这种很差的生物利用度显然是人类使用的主要障碍。在人和大鼠中,白藜芦醇快速地进行化合反应,导致在血浆中游离的白藜芦醇只有口服剂量的百分之一[38,39,40,41]。白藜芦醇的有效性取决于血流和靶组织中有足够水平的活性分子。
在体外和体内模型中,白藜芦醇的活性浓度范围为1至25μM[14,42,43]。因此,由于极其差的生物利用度,开发白藜芦醇在营养和治疗方面的应用一直受到极大限制。白藜芦醇的活性代谢物,主要是白藜芦醇-硫酸盐和白藜芦醇-葡萄糖醛酸盐,显示出更高的血浆水平,并且可能是在组织中达到并积聚在其中发挥其保护作用的唯一化合物[44]。已经对采取不同的策略以改善白藜芦醇生物利用度进行了评估[45]:(i)同时使用白藜芦醇代谢抑制剂; (ii)使用天然或化学合成的白藜芦醇类似物; 和(iii)新的白藜芦醇递送系统。使用脂质溶液,微粒体或其他矢量化形式也改善了白藜芦醇生物利用度[46]。口服白藜芦醇粉末,血浆白藜芦醇水平一般不会高于10ng / mL,除了一项研究声称达到了52ng / mL(相当于0.23μM)。我们小组最近的研究表明,在适当的脂质载体中的单剂量(40mg)的可溶形式的白藜芦醇在人体志愿者的血液中达到了微摩尔浓度(在30分钟时高达5.7μM; 相当于1400ng / mL) [34]。载体白藜芦醇吸收很好,并且保持生物有效血液浓度达几个小时,尽管代谢很快并经肾排除。相比之下,白藜芦醇粉末形式在任何时间都不能达到有效的血液浓度。使用可溶形式的低剂量的另一个好处是提高白藜芦醇耐受性。以前在人类志愿者中的剂量递增研究表明,1000毫克剂量的白藜芦醇不会引起明显的不良反应[38]。更高剂量偶尔可引起轻微的胃肠道反应[47]。也有报告称使用400mg的白藜芦醇出现轻微的不良反应,例如皮疹,头痛[48]。在我们的研究中,白藜芦醇具有良好的耐受性,并且在40mg的剂量下没有任何不良反应,尽管白藜芦醇血浆水平显着增加[34]。
2.3白藜芦醇保护关节的证据
2.3.1 体外研究结果
即使大多数体外研究报告使用的是白藜芦醇,我们仍然可以假定观察到的细胞效应是来自白藜芦醇的活性代谢产物而不是白藜芦醇本身。在基础培养基中,不考虑所经由的分子通路,关节软骨细胞对微摩尔剂量(0.1至10μM)的白藜芦醇的活性代谢产物的刺激具有抗性。由此可以得出以下几个假设。软骨细胞含有高水平的ceruleoplasmin,一种含铜蛋白质,具有很强的漆酶活性[49]。漆酶能够破坏和灭活白藜芦醇丙烯链的活性代谢物。原代培养的兔软骨细胞还具有特定的AhR含量和对其配体的响应性(图2,Widerak M,Corvol MT和Savouret JF,个人数据)。在基础培养条件下,AhR表达很弱,并局限在软骨细胞的细胞质区域(图2A)。在这些条件下,AhR不起作用,软骨细胞不响应AhR的主要配体二恶英(2,3,7,8-四氯二苯并对二恶英,TCDD)。添加白细胞介素(IL)-1β不改变这种区室定位。相反,在IL-1和TCDD存在下,AhR转移至细胞核(图2B)。在这些条件下,IL-1β刺激AP1活化,AhR表达增加,并且伴随CYP1A1和炎症小体标志物的表达增加(图2C)。
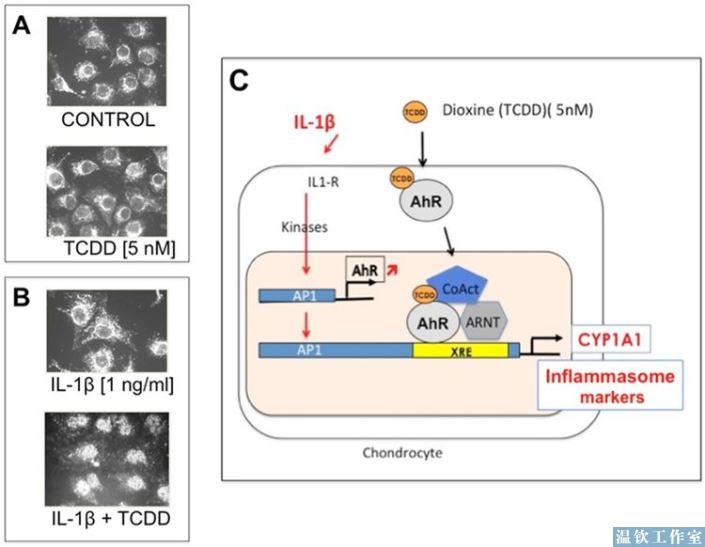
在体外基础培养条件下软骨细胞对白藜芦醇的活性代谢产物无明显响应可能来自低AhR基础水平,其值可能在其激活阈值之下。 在炎症条件下,如IL-1β的刺激,AhR含量可达到这样的阈值,允许白藜芦醇的活性代谢产物抑制AhR通路(图3)。 因此,白藜芦醇的活性代谢产物可能在炎症微环境中对软骨细胞更有效。
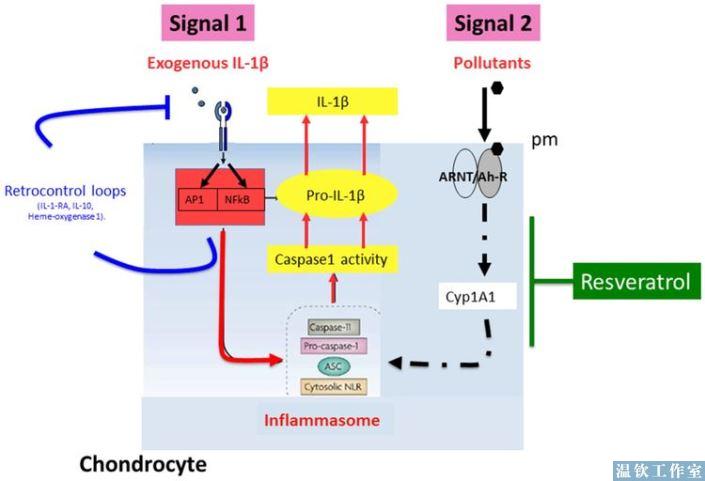
此外,越来越多的证据表明白藜芦醇的活性代谢产物对病理软骨细胞和滑膜细胞的作用。已经有几个研究小组报道了在软骨细胞(软骨内软骨和椎间盘)中白藜芦醇的活性代谢产物对IL-1β 和激酶对基质金属蛋白酶(MMP)-1,-3和-13表达的调节的抑制作用[ 51,52,53,54]。在部分以上这些研究中,白藜芦醇的活性代谢产物浓度范围为50至100μM。因此,不能排除通过ER-α激活的间接雌激素作用[55,56,57,58]。其他团队最近在软骨研究中开辟了新的道路,表明滑膜细胞,而不是软骨细胞,才是白藜芦醇的活性代谢产物抗炎活性的真正目标。不论是基础水平还是肿瘤坏死因子(TNF)α诱导下,白藜芦醇的活性代谢产物以剂量(在6和50μM之间)依赖性方式抑制IL-1β,MMP-3和磷酸化的Akt表达 [59]。有报道称在高剂量(50μM)时,滑膜细胞中胱天蛋白酶-8也是白藜芦醇的活性代谢产物的靶标[60]。所有作者得出结论,白藜芦醇的活性代谢产物可能在预防和治疗类风湿性关节炎(RA)中具有很好的效果。最后,白藜芦醇抑制单核细胞和内皮细胞之间的细胞粘附[61],这可能扩展到单核细胞与软骨细胞的相互作用的机制。作者将这种作用归因于酪氨酸激酶抑制,而这是白藜芦醇的活性代谢产物与AhR活化的主要作用; 尽管后一种机制也是ICAM-1表达的有效途径[62]。
2.3.2 临床前研究结果
虽然体外数据强烈支持白藜芦醇通过调节炎症,软骨溶解和血管生成的有效关节保护作用,白藜芦醇健康益处仍然有待在动物模型中的深入研究。 许多报告使用有疑问的给药方式(酒,干粉末形式)或错误的靶标,如曾经指出的血小板聚集[3]。 只有少数论文专门研究了白藜芦醇在骨关节炎(OA)或风湿性关节炎(RA)动物模型中的作用。
在骨关节炎动物模型的大多数研究中,研究者将白藜芦醇直接注射到关节内。在兔子骨关节炎模型中,横断单侧前十字韧带,关节内注射白藜芦醇可以阻止软骨破坏和抑制降解性可溶性因子产生的进展[63,64]。在王的研究中,关节内白藜芦醇以不同的剂量(50,20和10μmol/ kg)每天一次,连续两周。在白藜芦醇治疗组中,观察到软骨损伤,软骨细胞的凋亡率和滑液中一氧化氮的水平以剂量依赖性方式减少 [64]。与此一致,Elmali和同事证明,与注射DMSO的动物相比,用10μmol/ kg白藜芦醇注射两周的动物中软骨破坏得分和基质蛋白聚糖的损失减少。处理前两组之间的滑膜炎症评分相当[63]。最近,在骨关节炎的小鼠模型中,制造内侧半月板不稳定,每周在膝关节内注射白藜芦醇,伴随着软骨和软骨下骨变化减少,2型胶原表达不变以及iNOS和MMP-13表达和Sirt-1的激活的减少,和抑制缺氧诱导因子(HIF)-2α [65]。最近又评估了口服白藜芦醇补充剂对用高脂肪饮食喂养12周的C57BL / 6J小鼠的软骨保护作用。在这项研究中,评价骨关节炎组织学变化,软骨退化的II型胶原的C-端肽水平和通过TUNEL染色显示的凋亡在用低,中,高剂量口服白藜芦醇治疗的小鼠中减少[66]。据我们所知,在这些模型中没有涉及疼痛结果或AhR在AhR – / – 小鼠的遗传抑制的影响。
有趣的是,临床流行病学研究表明,酒精摄入,包括红葡萄酒,可能是风湿性关节炎的一个保护因素[67,68]。这导致了实验研究评估红葡萄酒化合物如白藜芦醇的作用。白藜芦醇减轻了胶原或脂多糖诱导的鼠关节炎中的软骨破坏和炎症[69,70,71,72]。从机械学的角度看,Xuzhu及其同事在小鼠胶原诱导的关节炎模型中证明,白藜芦醇的预防性或治疗性给药减弱了临床关节炎参数和骨侵蚀,并且与促炎细胞因子,胶原特异性IgG的血清水平降低相关,在受损淋巴结中的Th17细胞数量和IL-17减少。这些结果表明白藜芦醇在这个模型中的保护作用是通过调节关键的细胞和体液反应介导的[72]。最近,陈和同事在大鼠联合关节炎模型中报道,白藜芦醇(10或50mg / kg)显著降低爪肿胀和关节炎评分,抑制滑膜增生和炎症细胞浸润,并且降低COX -2和PGE2的产生 [69]。
最后,在大鼠卵巢切除诱导的骨质疏松症中口服白藜芦醇治疗显示具有一致的骨保护特性[73,74]。 最近,在8周龄的肥胖糖尿病小鼠,口服白藜芦醇三个星期与骨组织形态计量分析增加皮质面积,但减少骨长度相关联[75]。
2.4白藜芦醇治疗人类关节障碍相关症状的兴趣
尽管在过去十年中,在癌症,神经变性和心血管疾病,2型糖尿病和其他代谢性疾病[76]方面,食用多酚对人类健康的影响研究有显著和有争议的进展,但迄今为止针对白藜芦醇在关节疾病,特别是在骨关节炎(OA)或风湿性关节炎(RA)中的功效还没有临床数据。只有一个随机,双盲,对照试验评估了口服白藜芦醇对两个剂量(1000和150mg)与使用16周的口服安慰剂相比的肥胖男性的骨矿物质密度和骨碱性磷酸酶的作用。在这项研究中,高剂量白藜芦醇与骨碱性磷酸酶和腰脊骨小梁体积骨矿物质密度的增加相关,表明口服白藜芦醇对骨形成的潜在积极作用[77]。这种缺乏风湿病的试验可能与其他人类条件下白藜芦醇治疗相对较差结果相关的争议有关,特别是涉及到金融投资[78,79]。在最近的一项关于白藜芦醇在2型糖尿病中的有效性的荟萃分析中,Hausenblas和同事发现白藜芦醇补充剂在改善收缩压,血红蛋白A1c和肌酐比安慰剂/对照组更有效 [80]。然而,在2010年至2013年对白藜芦醇进行的所有临床试验的更广泛的评论中,Cottart及其同事未能证实白藜芦醇的明显有益效果[81]。作者指出要考虑在比较不同研究的结果时使用的方案的不同。此外,由于患者组通常较小,研究持续时间通常较短,和/或给予剂量通常较低,这可至少部分解释缺乏一致的阳性结果。最近,Semba及其同事进一步推动了对白藜芦醇临床阳性效应的争议,他们在意大利的783名65岁以上的社区男性和女性的人群样本中进行了为期9年的前瞻性队列研究。他们的研究结果表明,西方日常饮食达到的白藜芦醇水平不足以对健康状况和死亡率有实质性影响[82]。然而,测量24小时尿白藜芦醇代谢物来评价白藜芦醇暴露仅在基线水平仍然是一个争论,因为它可能并不能反映白藜芦醇在九年的随访期间的真实暴露[83]。
在人类中,仅通过日常饮食可能不会在靶组织处达到足够浓度的白藜芦醇的活性代谢物。然而,使用含有相对高含量的白藜芦醇的食品补充剂(每个胶囊55mg至超过500mg)可允许达到生物活性浓度,即使考虑到生物利用度因素[84]。
然而,从关节疾病领域的体外和临床前期研究,我们坚信除了传统治疗之外,只要有适当的时间和足够的生物利用度,服用白藜芦醇可以作为对人类关节障碍相关症状的补充治疗。
3.结论
几年来,基于体外和临床前期有希望的结果,白藜芦醇引起了浓厚的兴趣,因为它在从代谢疾病到癌症的几乎每个领域中的广泛作用。在风湿性疾病领域,体外证据明确支持白藜芦醇在各种关节细胞类型(包括软骨细胞和滑膜细胞)中的抗炎,抗分解代谢,抗凋亡和抗氧化性质,以及对T和B淋巴细胞免疫调节性质。白藜芦醇经关节内注射或口服,都同样显示在骨关节炎和风湿性关节炎的临床前期模型中的关节保护作用,主要通过减少促炎和促降解可溶性因子的产生,以及调节细胞和体液反应。为了下一步将白藜芦醇用于人类关节疾病的临床试验,已经开发了新的白藜芦醇制剂来改善其生物利用度和安全性[34],并且应当允许准确评估其在骨关节炎和风湿性关节炎中作为传统治疗的补充治疗的功效。
(参考文献略)
4,985 total views, 2 views today



 好处
好处  促进正常骨密度
促进正常骨密度
0 Comments